НАЦИОНАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ХИРУРГИЧЕСКОМУ ЛЕЧЕНИЮ БОЛЬНЫХ ХРОНИЧЕСКИМ ПАНКРЕАТИТОМ
РОССИЙСКОЕ ОБЩЕСТВО ХИРУРГОВ АССОЦИАЦИЯ ГЕПАТОПАНКРЕАТОБИЛИАРНЫХ ХИРУРГОВ СТРАН СНГ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ХИРУРГИЧЕСКОМУ ЛЕЧЕНИЮ БОЛЬНЫХ ХРОНИЧЕСКИМ ПАНКРЕАТИТОМ
Приняты на пленуме правления Ассоциации гепатопанкреатобилиарных
хирургов стран СНГ (Тюмень, Россия, 15-16 мая 2014 г.)
Координатор проекта:
академик РАМН, профессор Кубышкин Валерий Алексеевич (Москва)
Координаторы работы:
доктор медицинских наук, профессор Кригер Андрей Германович
(Москва),
доктор медицинских наук, профессор Вишневский Владимир Александрович
(Москва)
СОДЕРЖАНИЕ
1.
Определение
2.
Эпидемиология
3.
Этиология
4.
Классификации
хронического панкреатита
5.
Диагностика:
5.1
ультразвуковое исследование
5.2
эндоУЗИ
5.3
компьютерная томография
5.4
магнитно-резонансная томография
5.5
эзофагостродуоденоскаопия
6.
Хирургическое
лечение больных хроническим панкреатитом
6.1.
Дренирующие операции:
а) цистоеюностомия
б)
панкреатоеюностомия; в/ эндоскопические вмешательства
6.2.
Резекционные вмешательства
6.3.
Эндоваскулярные вмешательства при ложных аневризмах и комбинированное
радикальное лечение
7.
Послеоперационные
осложнения
СПИСОК СОКРАЩЕНИЙ
КТ -
компьютерная томография
ЛА - ложная
аневризма
МРТ –
магнитно-резонанская томография
ПДР –
панкреатодуоденальная резекция
ПЖ –
поджелудочная железа
ПП – панкреатический
проток
УЗИ –
ультразвуковое исследование
ХП - хронический
панкреатит
Область применения и цели рекомендаций
Идеология
создания национальных клинических рекомендаций базируется на необходимости применения
в клинической практике только стандартизированных методов диагностики и лечения,
эффективность которых доказана многоцентровыми рандомизированными
исследованиями.
Национальные
рекомендации предполагают обеспечить пациентов рациональными диагностическими
мероприятиями для раннего выявления заболеваний и выполнения оптимального
метода лечения. Кроме того, национальные рекомендации призваны защитить
больного от неоправданных действий, как на диагностическом, так и лечебном
этапе. При этом, последовательное выполнение рекомендаций обеспечивает врача
защитой медицинского сообщества при возникновении страхового или судебного
преследования.
Национальные клинические
рекомендации по хирургическому лечению больных хроническим панкреатитом относятся
к пациентам, у которых возникли осложнения заболевания, которые могут быть
корригированы посредством выполнения различных оперативных пособий.
Рекомендации предназначены для врачей общей практики, хирургов и терапевтов стационаров и поликлиник, а также гастроэнтерологов и эндокринологов.
Классификация показаний к лечебным вмешательствам по степени доказательной эффективности
В течение
последних двух десятилетий мировое сообщество использует следующую
Классификацию показаний к лечебным и диагностическим вмешательствам по степени
доказательной эффективности (табл. 1).
Таблица 1
Классификация показаний к лечебным и диагностическим
вмешательствам по степени доказательной эффективности
|
Классы |
Описание |
|
Класс I |
Состояния, для которых существуют доказательства
и/или общепринятое мнение, что данная процедура или лечение полезны и
эффективны. |
|
Класс II |
Состояния, для которых существуют противоречивые
данные и/или расхождение мнений о полезности/эффективности процедуры или лечения.
Показания определяются конкретной ситуацией, состоянием данного пациента.
Результат вмешательства не ясен и/или есть расхождения во мнениях
относительно полезности и эффективности. |
|
Класс II |
a) больше доказательств и/или мнений в пользу
целесообразности/эффективности; b) целесообразность/эффективность менее убедительны (то
есть не так хорошо подтверждены доказательствами, мнениями). |
|
Класс III |
Противопоказание. Вмешательство не полезно, а в
некоторых случаях, может быть и вредным. |
«Стандартными» рассматриваются методы, прошедшие многоцентровые клинические исследования и имеющие соответствующий уровень доказательности (табл. 2).
Таблица 2
Уровни доказательности исследований
|
Уровень доказательности |
Критерии |
|
А.
Высокая достоверность |
Основана на систематических обзорах
рандомизированных исследований или, как минимум, на одном рандомизированном,
контролируемом клиническом исследовании, хорошего качества и содержания по
теме рекомендации |
|
В.
Умеренная достоверность |
Основана на результатах, по меньшей
мере, одного независимого рандомизированного контролируемого клинического
испытания |
|
С.
Ограниченная достоверность |
Основаны на результатах, по меньшей
мере, одного клинического испытания, не удовлетворяющего критериям качества,
например, без рандомизации |
|
D. Неопределенная достоверность |
Утверждение основано на мнении
экспертов; клинические исследования отсутствуют |
Участники рабочей группы перевели и адаптировали текст согласительных документов, дополнили их материалами, взятыми из текстов Российских консенсусов и рекомендаций. Национальные рекомендации основаны на анализе результатов лечения больных ХП, опубликованных в ведущих периодических хирургических изданиях и монографиях, опубликованных за последние 5 лет в базах данных eLIBRARY, MEDLINE, SCOPUS, WEB OF SCIENCE и Cochrane Library по ключевым словам: хронический панкреатит (chronic pancreatitis), диагностика (diagnostics), эндоскопические вмешательства (endoscopic interventions), хирургическое лечение (surgery).
Список
цитируемой литературы, представленный в данных рекомендациях, является
дополнением к тем материалам, которые уже включены в вышеуказанные российские и
международные согласительные документы и рекомендации. Желающим ознакомиться с
литературой, представленной в этих документах, необходимо обратиться к
соответствующему первоисточнику.
Далее,
подготовленный вариант был направлен участникам экспертной группы для
согласования всех спорных вопросов оказания медицинской помощи пациентам именно
в условиях российского здравоохранения, после чего рекомендации были обсуждены
согласительной конференции в рамках XX Конгресса Ассоциации гепатопанкреатобилиарных хирургов стран СНГ (Донецк,
Украина, сентябрь
Клинические
рекомендации будут регулярно обновляться по мере появления новых методов,
технологий или доказательных положений.
1.
Введение
Хронический
панкреатит (ХП) является частым заболеванием органов брюшной полости.
Количество людей, страдающих ХП, увеличивается с каждым годом, при этом,
практически, все эти пациенты молоды и работоспособны, что придает болезни
выраженный социальный характер.
В настоящее
время в ведущих клиниках мира, специализирующихся на хирургическом лечении
больных ХП, сложились следующие концептуальные положения [9, 18, 47].
1. Возникновению
ХП способствуют различные этиологические факторы - алкогольные нагрузки, желчнокаменная
болезнь, перенесенный панкреонекроз (уровень доказательности А).
2. Биохимическая
диагностика степени поражения поджелудочной железы (ПЖ) при ХП отсутствует;
потеря экзокринной и эндокринной функций развивается по мере прогрессирования
заболевания (уровень доказательности А).
3. В процессе
развития заболевания возникают характерные осложнения - панкреатическая
гипертензия за счет вирсунголитиаза и стриктур панкреатического протока (ПП),
стенозы терминального отдела общего желчного протока и/или двенадцатиперстной
кишки, портальная гипертензия за счет компрессии воротной и верхней брыжеечной
вен. Терминальная стадия ХП характеризуется стеатореей и инсулинзависимым
сахарным диабетом (уровень доказательности А).
4. Комплексное
лучевое обследование больных позволяет определить патогномоничные признаки
поражения паренхимы и протоковой системы ПЖ (уровень доказательности А).
5. ХП является
фактором риска развития рака ПЖ (уровень доказательности В).
6. Общая
продолжительность жизни больных ХП уменьшается (уровень доказательности В).
Значительная
часть пациентов, страдающая ХП, подлежит хирургическому лечению, однако,
достаточно часто они неоправданно долго не получают специализированной помощи,
что приводит к развитию тяжелых необратимых патологических изменений ПЖ и стойкой инвалидности. В нашей стране
специализированная квалифицированная помощь больным, страдающим ХП, оказывается
в небольшом количестве крупных стационаров. Значительное число пациентов
лечится в общехирургических клиниках и не получает специализированной помощи.
В рекомендациях использована
градация уровней доказательств, опубликованная в «Consensus Guidelines on
Definition, Etiology, Diagnosis and Medical, Endoscopic and Surgical Management
of Chronic Pancreatitis German Society of Digestive and Metabolic Diseases» [34] и
«Italian consensus guidelines for chronic pancreatitis» [28] (табл.
1).
Основной целью
этих рекомендаций является раннее выявление больных ХП с последующим
направлением их в специализированные лечебные центры для оказания рациональной
квалифицированной хирургической помощи. Строгое соблюдение предлагаемых
рекомендаций предполагает улучшение результатов лечения больных ХП, что
приведет к улучшению здоровья нации.
2.
Определение
Хронический
панкреатит - хроническое рецидивирующее воспалительное заболевание ПЖ приводящее
к прогрессирующей атрофии железистой ткани органа, замещению соединительной
тканью клеточных элементов паренхимы, поражению протоков, болевому синдрому и
потере экзо- и эндокринной функций железы.
3.
Эпидемиология
ХП является
часто встречающимся заболеванием органов желудочно-кишечного тракта с
выраженным социально значимым фактором. В России заболеваемость ХП составляет
27,4-50 случаев на 100000 населения в год. В западных странах этот показатель
достигает значений от 1,6 до 56 случаев на 100000 населения в год [9, 18, 32, 47]. Около
20% больных ХП умирает от его осложнений в срок до 10 лет от момента
установления диагноза. 20-летняя выживаемость составляет только 45% [42].
Неблагоприятными прогностическими факторами, уменьшающими продолжительность
жизни этих больных, является продолжение приема алкоголя, курение и цирроз
печени [42].
4.
Этиология и патогенез
Основной причиной
развития ХП является злоупотребление алкоголем. ХП алкогольной природы
составляет 80% наблюдений. Тем не менее, только 10% людей, злоупотребляющих
приемом алкоголя, страдают ХП. Это преимущественно мужчины в возрасте от 25 до
50 лет. Ведущей причиной развития тяжелых изменений паренхимы ПЖ при ХП считают
генные мутации, среди которых основную роль отводят нарушениям в генах
трипсиногена и ингибитора протеазы серина (PRSS1 и SPINK1). Наследование этих
генетических дефектов может проявляться уже в детском возрасте [32, 43].
Другими
факторами, приводящими к развитию ХП, являются холецистохоледохолитиаз,
перенесенные операции, в том числе эндоскопические вмешательства на желчных и
панкреатических протоках, сопровождавшиеся послеоперационным панкреатитом,
закрытая травма живота с повреждением ПЖ. К менее распространенным факторам
относят: эндокринные заболевания (полиаденоматоз, гиперпаратиреоидизм, болезнь
Кушинга), беременность, гиперлипопротеинемию, длительный прием пероральных
контрацептивных средств и других лекарственных препаратов (кортикостероиды,
диуретики), иммунологические и аллергические факторы. Выделяют также
нейрогенный, наследственный, аутоиммунный, паразитарный панкреатиты, панкреатит
вирусной этиологии. Примерно в 10% наблюдений причина ХП остается неизвестной,
в таких случаях употребляется термин идиопатический ХП [7].
В метаанализе
работ, включающих 2000 наблюдений больных ХП, удельный вес желчнокаменной
болезни, как этиологического фактора ХП, достигает 24%, алкоголизма — от 38 до
85%, других причин — от 2 до 27%. Заключение о наличии «идиопатического»
панкреатита устанавливалось с частотой от 0 до 45% [1, 10].
Повреждение
стенки панкреатического протока, обусловленное хроническим или острым
воспалением, приводит к возникновению постнекротических кист, которые могут
достигать значительных размеров. В случаях, когда в стенке постнекротической
кисты располагается крупный артериальный сосуд, возникает аррозия его стенки с
поступлением крови в просвет постнекротической кисты и формируется ложная
аневризма (ЛА) [25, 35]. При наличии связи полости аневризм с ПП они
классифицируются как ЛА 1 типа [6]. Типичным клиническим проявлением этих
аневризм является кишечное кровотечение, обусловленным поступлением крови через
ПП в двенадцатиперстную кишку. Кроме того, ЛА могут формироваться в паренхиме
ПЖ и не иметь связи с ПП – ЛА 2 типа. Такие аневризмы, как правило, бывают
небольшого размера и протекают бессимптомно.
При наличии
эктопии ткани ПЖ в стенку вертикальной части двенадцатиперстной кишки у больных
ХП формируются воспалительные инфильтраты и кисты в толще стенки. Такое
состояние называется дуоденальной дистрофией. Характерным клиническим
проявлением дуоденальной дистрофии является нарушение пассажа пищи по
двенадцатиперстной кишке и болевой синдром. В редких случаях дуоденальная дистрофия
возникает без морфологических изменений паренхимы ПЖ, характерных для ХП.
Классификации
В настоящее
время единая и универсальная классификация ХП отсутствует. В тоже время, при
обсуждении хирургических аспектов лечения больных ХП, наметилась отчетливая тенденция
избегать классификаций ХП, указывая лишь осложнения заболевания, которые
требуют хирургического лечения.
Для
статистической обработки данных в масштабах страны необходимо использовать
Международную классификацию болезней и причин смерти 10-го пересмотра (МКБ-10)
(табл. 3), в которой представлен перечень патологических состояний, встречающихся
при ХП (параграфы К.86, К.90).
Таблица 3
Международная классификация болезней и причин
смерти (МКБ-10) Параграфы К.86 и К.90.
|
К.86.0
Алкогольный хронический панкреатит |
|
К.86.1 Другие
формы хронического панкреатита (инфекционный, непрерывно-рецидивирующий,
возвратный) |
|
К.86.2 Киста
поджелудочной железы |
|
К.86.3
Псевдокисты поджелудочной железы |
|
К.86.8 Другие
уточненные заболевания поджелудочной железы (атрофия, литиаз, фиброз, цирроз,
панкреатический инфантилизм, некроз) |
|
К.90.1
Панкреатическая стеаторрея |
Хирурги,
занимающиеся лечением больных ХП, должны знать наиболее распространенные
классификации ХП, используемые в мире: Марсельско-Римская (
Марсельско-Римская международная классификация (1988)
1. Хронический
кальцифицирующий ХП. Характеризуется образованием белковых пробок или камней в
протоках ПЖ. Встречается в 49-95%, имеет два подварианта - с твердыми правильными
кристаллами, обычно связанный с алкоголизмом и нарушением питания, и мягкими
рентгеннегативными камнями - обычно при наследственном хроническом панкреатите.
2. Хронический обструктивный
ХП (выявляется обструкция панкреатического протока или большого сосочка
двенадцатиперстной кишки камнем, опухолью, при стриктуре соска и т.д.).
3. Хронический
фиброзно-индуративный, или воспалительный хронический панкреатит.
Гистологически характеризуется наличием мононуклеарно-клеточной инфильтрации и
сопутствующим фиброзом паренхимы поджелудочной железы.
4. Хронические
кисты и псевдокисты ПЖ (кистозный ХП).
Таблица 4
Клиническая классификация хронического панкреатита
(M. Buchler с соавт., 2009)
|
Тип
хронического панкреатита |
Признаки |
|
А |
болевой синдром,
повторные приступы или острый панкреатит в анамнезе, нет осложнений*
панкреатита, стеаторреи или диабета. |
|
В |
болевой
синдром, есть осложнения панкреатита, нет нарушения функции ПЖ - стеаторреи,
диабета |
|
С С1 С2 С3 |
болевой
синдром, есть осложнения ХП или без них, присутствуют нарушения функции
железы (стеаторея, диабет) стеаторея
или диабет стеаторея
и диабет стеаторея
(диабет) и осложнения ХП |
*осложнения панкреатита: калькулез, кальциноз, желтуха, дуоденостаз,
стриктуры ПП, расширение ПП, кисты, свищи, спленомегалия, регионарная
портальная гипертензия, асцит
Рекомендации
Формулируя
диагноз у больного ХП, подлежащего лечению в хирургической клинике, необходимо
использовать код в соответствии с классификацией МКБ-10, а также указывать
осложнения, требующие хирургической коррекции (уровень доказательности С)
5. Диагностика
5.1.
Естественное течение хронического панкреатита
Течение ХП
зависит от факторов его возникновения. В случаях, когда заболевание является
следствием злоупотребления алкоголя, характерно латентное и длительное прогрессивное
течение с периодическими болевыми приступами, связанными с нарушением диеты. На
протяжении нескольких лет заболевание приводит к фиброзному перерождению
паренхимы, возникновению кальцинатов в паренхиме железы и камней в протоках,
возникновению интрапаренхиматозно расположенных кист и существенному снижению
экскреторной функции ПЖ.
Пациенты,
перенесшие панкреонекроз, имеют высокую вероятность возникновения псевдокист ПЖ
большого диаметра, а в тех случаях, когда выполнялось хирургическое лечение – формированию
наружных панкреатических свищей.
5.2.
Диагностика хронического панкреатита и его
осложнений
5.2.1.
Клинические проявления хронического панкреатита
Анамнестические
данные существенно помогают в диагностике ХП. Симптоматика ХП весьма
специфична. Основной жалобой является боль в верхнем отделе живота. Характер
боли может широко варьировать – от тупой или ноющей, до интенсивной, требующей
применения наркотических анальгетиков. Боль возникает после нарушения пищевого
рациона (приема алкоголя, жирной или острой пищи), однако, может не иметь связи
с нарушением диеты. Длительность болевого синдрома колеблется от нескольких
часов до суток и более. Повышение температуры тела, при отсутствии холангита
или абсцедирования постнекротических кист, тошнота и рвота не являются
типичными спутниками боли у больных ХП.
Больные,
страдающие ХП на протяжении длительного времени, могут жаловаться на
неустойчивый стул, обусловленный стеатореей.
Билиарная
гипертензия, регистрируемая у 30-35% больных, не всегда сопровождается желтухой.
Чаще она протекает бессимптомно. Механическая желтуха возникает у 15% больных.
Возникновению желтухи предшествует боль в верхнем отделе живота, характерная
для обострения ХП [17]. Желтуха характерна для больных с преимущественным
поражением головки ПЖ, что приводит к сдавлению терминального отдела общего
желчного протока.
Портальная
гипертензия, обусловленная сдавлением или тромбозом воротной, верхней
брыжеечной или селезеночной вен, отмечается у 7-18% больных. Кровотечения из
флебэктазий пищевода или желудка не являются частым осложнением ХП [11].
Нарушение
проходимости двенадцатиперстной кишки
присоединяется в тех случаях, когда у больных имеется дуоденальная дистрофия
(эктопия ткани ПЖ в стенку вертикальной части двенадцатиперстной кишки). Симптоматика
этого осложнения соответствует клинике стеноза выходного отдела желудка:
чувство тяжести в эпигастральной области после приема пищи, рвота пищей,
съеденной накануне. Развитие декомпенсированной формы нарушения эвакуации из
желудка не характерно [29].
Кишечные
кровотечения у больных ХП являются патогномоничным симптомом ЛА ветвей чревного
ствола и верхней брыжеечной артерии. Типичными проявлениями являются обильная
мелена и общие признаки острой кровопотери. При этом при гастродуоденоскопии не
обнаруживают изъязвлений в желудке и двенадцатиперстной кишке, флебэктазий
пищевода. Выделение крови из большого сосочка двенадцатиперстной кишки
регистрируется в 14% наблюдений при выполнении дуоденоскопии во время
кровотечения [6].
5.2.2.
Физикальное обследование
При осмотре
больных может быть выявлена желтушность кожи и склер. Пациенты, длительно
страдающие ХП, как правило, имеют дефицит массы тела. Осмотр живота позволяет
обнаружить ассиметрию передней брюшной стенки при наличии постнекротических
кист большого размера.
Пальпация
брюшной стенки при наличии болей уточняет их локализацию. Характерной
особенностью является отсутствие значимого усиления болей при пальпации и,
естественно, отсутствие перитониальных симптомов. Постнекротические кисты ПЖ
могут быть доступны пальпации при их значительных размерах. При этом они
пальпируются в верхней части живота в
виде эластичных не смещаемых опухолевидных образований с ровной поверхностью и
четкими контурами.
5.2.3.
Обследование больных хроническим панкреатитом
Для своевременного
выявления больных, страдающих ХП, необходима настороженность в отношении его
диагностики как у хирургов, так и терапевтов, гастроэнтерологов,
эндокринологов. При обнаружении у пациентов склонности к систематическому
приему алкоголя, в сочетании с наличием периодически возникающих болей в
животе, необходимо проведение скринингового обследования. Обязательному
динамическому наблюдению должны подлежать больные, перенесшие панкреонекроз.
Рекомендации
Выявление при
первичном обращении пациента к врачам любого профиля клинических симптомов,
характерных для ХП, требует дальнейшего целенаправленного лучевого обследования
больного для подтверждения или исключения ХП (уровень доказательности А)
Ультразвуковое
исследование
УЗИ следует
выполнять на аппаратах профессионального и экспертного классов. Сканирование
производится с применением В-режима, режимов второй гармоники, дуплексного
сканирования (в режимах цветового допплеровского картирования (ЦДК), энергии
отражённого допплеровского сигнала и импульсной допплерографии) и, по
возможности, панорамного сканирования. Исследование должно включать осмотр всех
органов брюшной полости, забрюшинного пространства и малого таза.
Характерными
ультразвуковыми признаками ХП, выявляемыми в В-режиме, являются увеличение размеров
ПЖ, повышение эхогенности паренхимы, неоднородность структуры за счет
множественных гиперэхогенных тяжей – участков фиброза, наличие кальцинатов
паренхимы и конкрементов в протоках ПЖ, диаметр ПП более
Постнекротические
кисты ПЖ визуализируются в виде анэхогенных жидкостных образований различной
формы, окруженных гиперэхогенной стенкой, содержимое которых может быть как
однородным, так и содержать секвестры в виде гиперэхогенных пристеночных
структур. При дуплексном сканировании в стенках псевдокист и внутриполостных
структурах кровоток не регистрируется. При наличии ЛА бассейна чревного ствола
и верхней брыжеечной артерии полость кисты окрашивается в режимах цветового и
энергетического картирования с регистрацией в полости артериального кровотока с
турбулентным спектром [23].
Режимы дуплексного
сканирования необходимо использовать для качественной и количественной оценки
вен портальной системы для выявления возможной внепеченочной портальной
гипертензии и тромбоза воротной, селезеночной и верхней брыжеечной вен.
Дифференциальная диагностика псевдотуморозного панкреатита и опухолей ПЖ, постнекротических кист и кистозных опухолей ПЖ должна являться обязательной частью исследования. Наиболее чувствительным критерием дифференциальной диагностики кистозных опухолей и постнекротических кист является наличие сосудов в капсуле, перегородках и пристеночном компоненте (папиллярных разрастаниях), что характерно для кистозных опухолей и не бывает при постнекротических кистах.
О наличии у пациентов дуоденальной дистрофии свидетельствуют кистозные полости в структуре утолщенной стенки двенадцатиперстной кишки, обладающие такими же ультразвуковыми характеристиками, как и псевдокисты ПЖ. Дифференциально-диагностическим критерием от постнекротических кист головки ПЖ является локализация гастродуоденальной артерии медиально от кистозных образований в стенке кишки [23].
Рекомендации
Для скрининга
населения должно использоваться УЗИ, в связи с отсутствием инвазивности,
простотой выполнения, высокой специфичностью и чувствительностью в определении
основных проявлений ХП – увеличение размеров ПЖ, наличия расширения ПП,
вирсунголитиаза и кальциноза паренхимы (уровень доказательности А)
Эндосонография
Эндосонография
является наиболее чувствительным методом для выявления ХП и входит в
международные алгоритмы исследования пациентов, у которых подозревается ХП [19].
Этому исследованию всегда предшествует стандартное эндоскопическое исследование
верхних отделов желудочно-кишечного тракта, при котором могут быть выявлены как
косвенные признаки ХП, так и сопутствующие заболевания.
Степень
выраженности ХП оценивается по классификации, принятой в 2007 году (Rosemont classification)
[20]. По этой классификации все изменения ПЖ разделяются на большие и малые
признаки, коррелирующие с изменениями, выявляемыми при морфологическом
исследовании ткани органа.
Ультразвуковая семиотика
поражения паренхимы ПЖ при ХП, выявляемая при эндосонографии, совпадает с
таковой при трансабдоминальном сканировании. Однако приближенность датчика к
органу и отсутствие артефактов позволяют получить более полную информацию о
состоянии стенки двенадцатиперстной кишки, паренхимы ПЖ и ее протоковой
системы. Под эндосонографическим контролем может быть произведена
диагностическая пункционная биопсия, для цитологической и гистологической
верификации сомнительных зон с целью дифференциальной диагностики псевдотуморозного
панкреатита, аутоиммунного панкреатита и опухолевого поражения, внутреннее
дренирование постнекротических кист [20].
Эндосонография с
секретиновым тестом является наиболее надежным методом визуализации изменений
паренхимы и протоков ПЖ на ранних стадиях заболевания [29].
Однако интерпретация данных затруднена из-за отсутствия единых диагностических
критериев, большой вариабельности пороговых величин и результатов у разных
исследователей, а также отсутствием стандартной терминологии.
Рекомендации
Эндосонографию
целесообразно выполнять при дифференциальной диагностике ХП и других
воспалительных и опухолевых заболеваний, а также с целью получения
исчерпывающей информации о состоянии двенадцатиперстной кишки при наличии
дуоденальной дистрофии. Эндосонография с секретиновым тестом позволяет диагностировать начальные
изменения паренхимы и протоков ПЖ (уровень
доказательности В)
Компьютерная
томография
При определении тактики
хирургического лечения КТ диагностика с болюсным контрастным усилением имеет наивысший
приоритет [30]. КТ обследование больных с ХП должно включать в себя
исследование всех органов брюшной полости, забрюшинного пространства, малого
таза и базальных отделов легких.
КТ позволяет
оценить размеры любого отдела железы в аксиальной, сагитальной и фронтальной
плоскостях, а также плотность ткани в единицах Хаунсфилда. Кальцинаты и
конкременты в ПП хорошо видны на фоне паренхимы ПЖ без контрастного усиления.
Контрастное усиление при КТ является обязательной составляющей исследования. Эффективность контрастного усиления обеспечивается скоростью введения и дозой контрастного вещества. Доза контрастного препарата рассчитывается согласно инструкции по применению с учетом веса и индекса массы тела. Исследование с применением йодсодержащих препаратов безопасно применять не чаще одного раза в 12 дней с контролем экскреторной функции почек. Контрастное усиление позволяет получить достоверную информацию в артериальную, венозную и отсроченную фазы контрастного усиления. Максимальное накопление контрастного препарата паренхимой ПЖ происходит в артериальную фазу. На этом фоне отчетливо визуализируются участки некроза ткани.
Специфическими симптомами ХП являются наличие кальцинатов и псевдокист в паренхиме железы, увеличение диаметра и наличие конкрементов в ПП [5, 41].
На фоне
контрастированной паренхимы степень расширения ПП и его равномерность видна
лучше, чем при нативном исследовании. Кроме того, структурные изменения
выстилки протоков лучше визуализируются при контрастном усилении - папиллярные
разрастания отличают внутрипротоковую папилярно-муцинозную опухоль от
расширения ПП при панкреатической гипертензии на фоне хронического воспаления.
Постнекротические
кисты наиболее четко можно верифицировать при анализе постконтрастных
изображений, так же как и состояние протоков и парапанкреатических структур
(изменение стенки и просвета
двенадцатиперстной кишки, расширение желчных протоков, увеличение
лимфатических узлов различных групп, состояние сосудов). Постнеротические кисты
не меняют плотности и размеров после контрастирования, что помогает в
проведении дифференциального диагноза с кистозными опухолями. Отсутствие
контрастирования мягкотканной структуры в кистозной полости – признак наличия
секвестра в просвете. Контрастирование мягкотканых разрастаний на стенке кисты
является признаком кистозной опухоли. Неоднородный
состав полости псевдокисты с наличием масс, соответствующих по плотности
гематоме, может свидетельствовать о кровотечении в полость кисты.
Рекомендации
Компьютерная
томография с болюсным усилением является методом выбора при диагностике
хронического панкреатита (уровень доказательности А). Ограничивающими факторами
являются непереносимость больным йодсодержащих контрастных препаратов, почечная
недостаточность,
лучевая нагрузка на пациента
Магнитно-резонансная
томография
Выполнение МРТ
предпочтительнее у пациентов с непереносимостью йодсодержащих контрастных
препаратов.
Данными МРТ,
указывающими на ХП, являются снижение интенсивности сигнала на T1 В.И. при
подавлении сигнала от жировой ткани и снижение контрастности. При выполнении магнитно-резонансной
холангиопанкреатографии (МРПХГ) можно с высокой точностью определить заполненные
жидкостью структуры – ПП и псевдокисты.
Наличие жидкости
внутри псевдокисты является естественным контрастом, что позволяет
диагностировать последнюю как при стандартной МРТ, так и при МРХПГ. В режиме Т2
и Т2-STIR В.И. кисты имеют однородный гиперинтенсивный МР-сигнал, четкие ровные
контуры. МРТ дает возможность различать и геморрагический компонент жидкости,
который определяется в виде гиперинтенсивного МР-сигнала в Т1-FFE ВИ, что
объясняется значительным парамагнитным эффектом метгемоглобина [19]
МРХПГ является
наиболее информативным в дифференциальной диагностике причин билиарной и
панкреатической гипертензии и выполняется с целью уточнения изменений в
протоковой системе (уровень доказательности В) [48]. Однако, поскольку боковые
ветви визуализируются только в 10–25% случаев [55],
данный вид исследования имеет ограниченное диагностическое значение на ранних
стадиях ХП.
Недостатком МРТ
является то, что при наличии кальцинатов (что достаточно характерно для
хронического панкреатита) этот метод не может иметь такой высокой специфичности
как КТ. Вместе с тем присутствие участков очень низкой интенсивности сигнала
предполагает наличие кальцинированных зон, симптоматичных для воспалительного
процесса [3].
МРПХГ с
использованием секретина имеет очень высокую чувствительность [35] и может быть ценной у небольшой группы пациентов,
у которых иначе невозможно подтвердить предполагаемый диагноз ХП.
Рекомендации
Выполнение МРТ целесообразно у пациентов с
непереносимостью йодсодержащих контрастных препаратов, метод является наиболее
информативным в дифференциальной диагностике причин билиарной и панкреатической
гипертензии. Динамическая МРПХГ с секретиновым тестом – основной неинвазивный
метод идентификации начальных морфологических изменений протоков ПЖ, жидкостных
структур, а также оценки внешнесекреторного резерва железы (уровень
доказательности В)
Эндоскопическая ретроградная панкреатохолангиография
Эндоскопическую
ретроградную панкреатохолангиографию (ЭРПХГ) в последнее время для диагностики ХП
применяют не часто, так как обладая высокой диагностической информативностью, ЭРПХГ
не исключает возможности развития серьезных осложнений (острого панкреатита,
холангита, сепсиса, ретродуоденальной перфорации). Недостатком является также
невозможность оценить изменения непосредственно паренхимы железы.
ЭРПХГ
позволяет детально оценить состояние протока ПЖ и его ветвей. Наибольшую
ценность ЭРПХГ представляет при отсутствии данных эндосонографии или
сомнительных результатах МРПХГ. Критерии оценки тяжести ХП по Кембриджской
классификации приведены в таблице 5.
Таблица 5
Классификация
панкреатограмм при ХП
|
Терминология |
ГПП |
Изменённые
боковые протоки |
Дополнительные
признаки |
|
Норма |
Норма |
Нет |
- |
|
Сомнительные
данные |
Норма |
<3 |
- |
|
Лёгкий
ХП |
Норма |
≥3 |
- |
|
Умеренно
тяжёлый ХП |
Изменён |
>3 |
- |
|
Тяжелый
ХП |
Изменён |
>3 |
Один и более: большие полости,
обструкция, дефекты наполнения, выраженное расширение или неравномерность |
6. Эндоскопическое и хирургическое лечение хронического панкреатита
Эндоскопическое
и хирургическое лечение ХП показано при наличии осложнений заболевания. К ним
относятся: 1)стойкий болевой синдром, не поддающийся медикаментозной терапии;
2) протоковая гипертензия ПЖ за счет вирсунголитиаза или стриктур ПП; 3) постнекротические
кисты ПЖ; 4) механическая желтуха, обусловленная компрессией терминального
отдела общего желчного протока; 4) портальная гипертензия за счет сдавления
конфлюенса воротной вены; 5) нарушение пассажа пищи по двенадцатиперстной
кишке, обусловленное дуоденальной дистрофией; 6) ЛА бассейна чревного ствола и
верхней брыжеечной артерии [44]. На фоне перечисленных осложнений могут
возникать панкреатогенный асцит и\или плеврит; у больных, оперированных по
поводу панкреатита или перенесших травму ПЖ - панкреатические свищи [44].
Объем и способ
выполнения операции определяется характером осложнения, которое необходимо
устранить. Операции при ХП делятся на дренирующие и резекционные. При ЛА
артерий, кровоснабжающих ПЖ, лечение должно начинаться с эндоваскулярного
вмешательства, а затем производиться операция, радикально устраняющая
патологическое состояние, приведшее к аррозии сосуда [8].
Предоперационная подготовка
Подготовка
больных к операции должна включать коррекцию алиментарных и водно-электролитных
нарушений. У больных, страдающих сахарным диабетом, необходимо проводить
терапию с участием эндокринолога. При наличии дуоденальной дистрофии с
нарушением дуоденальной проходимости требуется интенсивная терапия с элементами
гипералиментации.
6.1.
Дренирующие операции
Дренирующие
операции (эндоскопическое стентирование панкреатического протока, внутреннее и
наружное дренирование постнекротических кист, цистопанкреатоеюностомия,
продольная панкреатоеюностомия) направлены на устранение боли, гипертензии
протоковой системы ПЖ и желчных протоков, сдавления прилежащих органов.
6.1.1.
Эндоскопическое лечение вирсунголитиаза, стентирование панкреатического протока
Литоэкстракция и
механическая литотрипсия целесообразны при единичных конкрементах диаметром не
более 5 мм, располагающихся в ПП на уровне головки и тела ПЖ.
Стентирование ПП
целесообразно выполнять при наличии значимых стриктур – увеличения диаметра
протока более
Для успешного стентирования панкреатического
протока требуется выполнить панкреатикосфинктеротомию и дилатацию стриктуры,
устранить вирсунголитиаз. Стентирование осуществляется пластиковыми стентами
диаметром 8,5 - 10 Fr, длина и форма которых подбираются индивидуально.
Металлические самораскрывающиеся стенты применяться не должны. Обтурация
пластиковых стентов происходит через 2-3 месяца, что требует их замены [50].
Осложнения при
стентировании панкреатического протока (обострение панкреатита, проксимальная
или дистальная миграция стента, абсцесс ПЖ) наблюдаются в 6 - 39% наблюдений
[24].
6.1.2
Дренирующие операции при постнекротических кистах поджелудочной железы
Показаниями к
дренированию постнекротических кист являются размеры кисты более
Устранение кист
может быть выполнено за счет внутреннего эндоскопического дренирования в
просвет двенадцатиперстной кишки или желудка, а также «открытым» хирургическим
доступом. Наружное дренирование под ультразвуковым контролем является
вынужденной мерой и показано лишь при абсцедировании или крайне тяжелом
состоянии больного. Исходом наружного дренирования постнекротической кисты часто
является формирование наружного панкреатического свища, который в последующем
часто требует хирургического лечения [41].
Тактика
хирургического лечения определяется степенью выраженности стенки кисты,
наличием или отсутствием в просвете кисты секвестров и инфицирования,
технической оснащенностью и уровнем квалификации хирургических кадров.
Эндоскопическое дренирование полости кисты в двенадцатиперстную кишку или
желудок. Эндоскопическое внутреннее дренирование является
методом выбора при неосложненных псевдокистах ПЖ в случаях, когда киста
прилежит к стенке двенадцатиперстной кишки (предпочтительно) или желудка, при
отсутствии в полости кисты крупных секвестров. Дренирование должно выполняться
под эндосонографическим контролем, позволяющем выбрать безопасную трассу
проведения дренажа. Для дренирования следует использовать самораскрывающиеся металлические
покрытые стенты, или использовать не менее 2 пластиковых стентов. Стенты не
следует удалять до инструментального подтверждения спадения стенок кисты и
ранее 2 месяцев после их имплантации. Этот метод позволяет добиться успеха в
92% случаев. Однако, ближайшие результаты
лучше отдаленных, рецидивы возникают в 8,5 -23%, осложнения – 14,4% [36,
49].
Транспапиллярный подход используют при постнекротических
кистах, связанных с ПП при его проксимальной обструкции. Этот метод не
эффективен при локализации кист в области хвоста ПЖ.
Лечение
билиарной гипертензии при хроническом панкреатите. Эндоскопическое
лечение билиарной гипертензии при хроническом панкреатите показано при клинически значимом холангите и механической
желтухе. При неэффективности предшествующего эндоскопического лечения и
несоблюдении пациентом лечебного режима эндоскопическое лечение не показано.
Эндоскопическое лечение заключается в стентировании желчных протоков
множественными билиодуоденальными пластиковыми стентами. Каждые 3 месяца
требуется замена стентов. Курс лечения составляет 1 год. Эффективность данного
лечения в отдалённом периоде достигает 65%.
Больные требуют динамического наблюдения из-за риска развития
септических осложнений, связанных с окклюзией или миграцией стентов.
Недопустимо применение непокрытых и частично покрытых самораскрывающихся
металлических стентов в качестве окончательного метода лечения из-за малых
сроков функционирования стента и невозможностью их извлечения при ЭРХПГ.
Цистопанкреатоеюностомия – обеспечивает
выздоровление в 90-100% наблюдений, при отсутствии фиброзного изменения ткани
ПЖ проксимальнее постнекротической кисты. Послеоперационные осложнения бывают в
20% [39]. Предпочтение следует отдавать миниинвазивному доступу по М.И. Прудкову.
Анастомозирование кисты следует выполнять с отключенной по Ру петлей тощей
кишки длиной не менее
Продольная
панкреатоеюностомия позволяет надежно устранить
протоковую гипертензию на уровне дорзального сегмента головки, тела и хвоста
ПЖ. При фиброзном перерождении паренхимы головки и крючковидного отростка ПЖ,
наличии камней или стриктур в терминальной части ПП операция не эффективна.
Поскольку в большинстве случаев при ХП наибольшие склеротические изменения
возникают именно в головке ПЖ, показания к продольной панкреатоеюностомии
возникают редко [37].
Просвет ПП
вскрывается на всем протяжении - от головки до хвоста ПЖ. Гемостаз при
капиллярном кровотечении обеспечивается коагуляцией, кровоточащие артериальные
и венозные сосуды прошиваются. Удаляются камни из ПП и его ветвей. При
затруднениях обнаружения ПП, а также для оценки радикальности операции, следует
выполнить интраоперационное УЗИ. Паренхиму железы, даже при наличии
интрапаренхиматозных кальцинатов, не иссекают. Панкреатоеюноанастомоз с
изолированной по Ру петлей кишки (см. выше) формируют непрерывным обвивным швом
монофиломентной рассасывающейся нитью. Ру-петлю проводят через окно в брыжейке
поперечной ободочной кишки.
Рекомендации
Эндоскопическое транспапиллярное стентирование панкреатического протока
пластиковым стентом диаметром 10 Fr показано при наличии одиночной стриктуры с
увеличением диаметра протока более
Эндоскопическое устранение билиарной
гипертензии при хроническом панкреатите показано при клинически значимом холангите и механической
желтухе. Стентирование желчных протоков
проиводится множественными билиодуоденальными пластиковыми стентами. Каждые 3
месяца требуется замена стентов. Курс лечения составляет 1 год (уровень доказательности А).
Эндоскопическое внутреннее дренирование постнекротической кисты ПЖ показано
в случаях прилежания полости кисты к стенке желудка или двенадцатиперстной
кишки, размере кисты более
Цистопанкреатоеюностомия «открытым» способом или через мини-доступ показана
при постнекротических кистах большого размера любой локализации с наличием
хорошо сформированной капсулы, крупными секвестрами в полости (уровень
доказательности В).
Показанием для наружного дренирования постнекротической кисты является
абсцедирование, отсутствие сформированной капсулы или возможности выполнить
более сложное вмешательство из-за тяжести состояния больного или технических
причин (уровень доказательности А).
Продольная панкреатоеюностомия показана при наличии протоковой гипертензии и расширении ГПП за счет его стриктур или камней на уровне перешейка, тела и хвоста ПЖ и отсутствии фиброзного перерождения головки и крючковидного отростка ПЖ (уровень доказательности С).
6.2.
Резекционные операции при хроническом панкреатите
Резекционные
вмешательства на ПЖ в настоящее время хорошо разработаны и являются приоритетными,
поскольку позволяют радикально устранить осложнения ХП, обусловленные
фиброзно-кистозным перерождением головки или дистального отдела органа [44].
Существует несколько вариантов резекции головки ПЖ, каждый из которых имеет
строгие показания [15, 52].
Резекция головки ПЖ с продольным панкреатоеюноанастомозом (операция Фрея) обеспечивает
надежное устранение панкреатической гипертензии и удаление большей
части фиброзно измененной ткани головки ПЖ, как предложено в модифицированном в
2003 году варианте операции [26,60].
ПП вскрывают на
всем протяжении. Ткань головки и крючковидного отростка иссекают, с сохранением
не более
Эта операция не
обеспечивает полного обнажения из ткани ПЖ терминального отдела общего желчного
протока и воротной вены. За счет большой раневой поверхности в зоне резекции
головки, крючковидного отростка и рассеченного ГПП в ближайшем
послеоперационном периоде высока вероятность возникновения раннего кровотечения
в просвет анастомоза.
Субтотальная резекция головки ПЖ (бернский вариант резекции головки ПЖ).
При этом варианте резекции объем удаляемой ткани ПЖ увеличивается за счет
полного иссечения паренхимы, прилежащей к интрамуральной части общего желчного
протока. При наличии желчной гипертензии, механической желтухи просвет желчного
протока может быть вскрыт. Образовавшиеся лоскуты стенки желчного протока
подшивают к оставшейся ткани железы. ПП, при наличии в нем камней или стриктур,
рассекают, как при операции Фрея. Ру-петлю тощей кишки подшивают по периметру
резецированной головки, крючковидного отростка и ПП. Недостатком этой операции
является реальная возможность возникновения стриктуры общего желчного протока внутри
полости анастомоза [31]. При наличии протяженной стриктуры общего желчного
протока вскрывать его просвет в образовавшейся после резекции головки полости
не целесообразно. Наиболее надежным способом устранения желчной гипертензии
является наложение гепатикоеюноанастомоза на отключенной по Ру петле тощей
кишки.
Субтотальная резекция головки ПЖ с пересечением перешейка ПЖ (операция
Бегера). ПЖ мобилизуют в области перешейка, под которым
создают туннель, обнажающий переднюю поверхность конфлюенса воротной вены.
Воротную и верхнюю брыжеечную вену выделяют из рубцового футляра, окружающего и
сдавливающего вены. Ткань головки и крючковидного отростка резецируют с
оставлением полоски паренхимы вдоль медиальной стенки двенадцатиперстной кишки
и терминальной части общего желчного протока толщиной не более
Панкреатодуоденальная резекция при ХП является
вынужденной операцией, к которой прибегают в случаях, когда, несмотря на весь
арсенал лучевых методов диагностики, не удается исключить наличие опухоли ПЖ. Кроме
того, показанием для ПДР служит наличие дуоденальной дистрофии в сочетании с
фиброзно-кистозным перерождением головки ПЖ.
Дистальная резекция ПЖ при ХП выполняется в
случаях, когда не удается исключить наличие опухоли хвоста ПЖ; в редких случаях
- при постнекротических кистах, полностью замещающих хвост ПЖ, при условии
отсутствия нарушения оттока секрета по ПП в области тела и головки ПЖ, что
требует наложение цистопанкреатоеюноанастомоза. При выполнении дистальной
резекции ПЖ, в случаях, когда селезеночные сосуды удается отделить от стенок
постнекротической кисты, следует избегать спленэктомии.
Рекомендации
Резекция головки ПЖ с продольным панкреатоеюноанастомозом (операция Фрея)
показана при фиброзной трансформации головки ПЖ, панкреатической гипертензии,
обусловленной калькулезом ПП или его стриктурами (уровень доказательности С).
Бернский вариант резекции головки ПЖ показан при наличии не только
фиброзного перерождения паренхимы головки, но и билиарной гипертензии (уровень
доказательности С).
Субтотальная резекция головки ПЖ по Бегеру показана при наличии
перечисленных осложнений в сочетании с портальной гипертензией, обусловленной
сдавлением конфлюенса воротной вены (уровень доказательности С).
Панкреатодуоденальная резекция показана в случаях, когда не удается
исключить наличие злокачественной опухоли головки ПЖ, а также при фиброзном
изменении головки ПЖ в сочетании с дуоденальной дистрофией, а также (уровень
доказательности D).
Дистальная резекция ПЖ показана в случаях, когда не удается исключить
наличие опухоли хвоста ПЖ, возможно выполнение этой операции пр и
постекротической кисте ПЖ, замещающей паренхиму дистальной части органа (уровень доказательности С).
6.3.
Эндоваскулярные вмешательства при ложных аневризмах
бассейна чревного ствола и верхней брыжеечной артерии
Больные с ЛА 1
типа на момент установления диагноза, практически, всегда находятся в тяжелом
состоянии, обусловленным анемией из-за рецидивирующих кишечных кровотечений.
Из-за тяжести состояния пациентов радикальное хирургическое лечение выполнить
не возможно. На первом этапе лечения необходимо добиться прекращения
рецидивирующих кровотечений за счет срочного эндоваскулярного вмешательства
[25, 35].
Рекомендуются
следующие варианты эндоваскулярных вмешательств: окклюзия артерии дистальнее и
проксимальнее шейки аневризмы (рис. 1); окклюзия полости аневризмы и
афферентной артерии (рис. 2); эндопротезирование артерии покрытым стентом на
уровне шейки аневризмы (рис. 3).
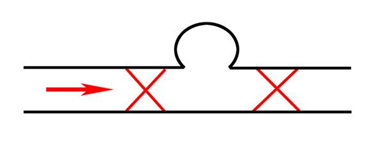
Рис. 1 Окклюзия артерии дистальнее и проксимальнее шейки аневризмы
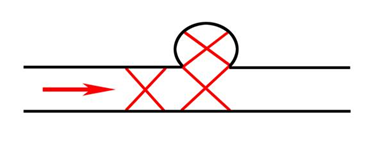
Рис. 2. Окклюзия полости аневризмы и афферентной артерии
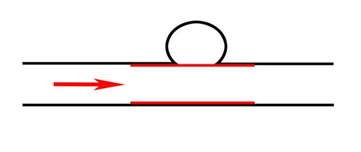
Рис. 3. Эндопротезирование артерии покрытым стентом на уровне шейки аневризмы
Эндоваскулярное
«выключение» ЛА из кровотока позволяет устранить рецидивирующие кишечные
кровотечения. Однако, за счет сообщения полости ЛА 1 типа с просветом ПП,
воздействие панкреатического сока
приводит к лизису тромботических масс через 2-3 недели после эмболизации
(за исключением случаев, когда выполнено эндопротезирование покрытым стентом) [6].
После интенсивной подготовки, направленной на устранение анемии и
гипопротеинемии, необходимо проведение радикального хирургического
вмешательства, направленного на устранение осложнений ХП, приведших к
возникновению ЛА.
Ложные аневризмы
2 типа, не имеющие сообщения с ПП, подлежат эндоваскулярному лечению, которое
обеспечивает тромбирование полости аневризмы [6].
Рекомендации
Больные
с ЛА 1 типа подлежат двухэтапному лечению: эндоваскулярному устранению
кишечного кровотечения за счет «выключения» ЛА из кровотока с последующим
радикальным хирургическим лечения осложнений ХП (уровень доказательности С).
При
ЛА 2 типа показано эндоваскулярное лечение (уровень доказательности D).
7.
Послеоперационные осложнения
Операции при ХП
сопровождаются большим числом послеоперационных осложнений, достигающих 20-40%
[5, 12]. В тех случаях, когда паренхима ПЖ, на момент операции не утратила
секреторной активности, имеется реальная угроза возникновения
послеоперационного панкреатита и формирования панкреатических свищей [3, 12].
Обширные резекции головки ПЖ с большой площадью раневой поверхности, создают
условия для возникновения ранних кровотечений в просвет
панкреатоеюноанастомоза.
Послеоперационный
панкреатит является частым осложнением после операций на ПЖ. Макроскопические
проявления панкреатита в виде стекловидного отека парапанкреатической клетчатки
и даже бляшек стеатонекроза могут регистрироваться уже во время операции [3]. В
ближайшем послеоперационном периоде клиническими признаками панкреатита
являются проявления эндогенной интоксикации (стойкая тахикардия при отсутствии
гиповолемии, акроцианоз, угнетение самостоятельного дыхания), выделение из
брюшной полости по дренажным трубкам экссудата бурого цвета с высоким
содержанием амилазы, гастростаз и паралитическая кишечная непроходимость.
Перечисленные симптомы свидетельствуют о развитии панкреонекроза.
Биохимическим
маркером панкреатита является повышение уровня амилазы в крови свыше 500 ед/л.
Лечение
послеоперационного панкреатита должно быть консервативным и проводиться в
условиях отделения реанимации [3]. Схема базисной консервативной терапии
включает антибактериальную терапия с целью профилактики и лечение септических
осложнений; подавление секреции ПЖ, желудка и двенадцатиперстной кишки; устранение
гиповолемии с коррекцией водно-электролитных и метаболических нарушений;
улучшение реологических свойств крови; профилактику и лечение функциональной
недостаточности желудочно-кишечного тракта; анальгетическую и антиферментативную
терапию. При панкреонекрозе целесообразно использование экстракорпоральных
методов детоксикации.
В качестве
профилактики послеоперационного панкреатита следует использовать октреотид в
дозе 100-300 мкг подкожно 3 раза/сутки в течение 5 дней в зависимости от
тяжести заболевания. Возможно назначение препарата в суточной дозе до 1200 мкг
с использованием внутривенного пути введения [2].
Необходимость в
экстренном хирургическом лечении возникает лишь при панкреонекрозе, осложнившимся
распространенным гнойным перитонитом, как правило, обусловленным
несостоятельностью швов панкреатодигестивного анастомоза [33].
Панкреатические свищи являются результатом
послеоперационного панкреатита, на фоне которого возникает несостоятельность
швов панкреатодигестивных анастомозов или культи ПЖ после дистальных резекций
[40]. Панкреатические свищи делятся на 3 типа (табл. 6) [16].
Таблица
6
Классификация
ПС по ISGPF(2005)
|
Критерии |
Нет свища |
Тип А |
Тип В |
Тип С |
|
Содержание
амилазы в отделяемом по дренажу |
<3 раз превышает нормальный
уровень амилазы в сыворотке крови |
>3 раз превышает нормальную
амилазу сыворотки крови |
>3 раз превышает нормальную
амилазу сыворотки крови |
>3 раз превышает нормальную
амилазу сыворотки крови |
|
Клиническое
состояние больного |
Удовлетворительное |
удовлетворительное |
средней степени тяжести |
Тяжёлое |
|
Специфическое
лечение |
Да |
да |
да/нет |
Да |
|
УЗИ и КТ
признаки панкреатита |
нет |
нет |
да/нет |
да |
|
Дренаж более
3 недель |
Нет |
нет |
да |
Да |
|
Признаки
инфекции1 |
Нет |
нет |
да |
Да |
|
Повторная госпитализация2 |
Нет |
нет |
да/нет |
да/нет |
|
Тяжёлый
сепсис |
Нет |
нет |
нет |
Да |
|
Необходимость
повторной операции |
Нет |
нет |
нет |
Да |
|
Летальный
исход |
Нет |
нет |
нет |
Да |
1Признаки инфекции включают гипертермию более
2Повторная госпитализация в течение 30 дней после выписки из стационара.
Рекомендации
Послеоперационный
панкреатит требует проведения интенсивной консервативной терапии в условиях
отделения реанимации (уровень доказательности А).
Показанием
к хирургическому лечению является гнойный перитонит, обусловленный
панкреонекрозом и несостоятельностью швов панкреатодигестивного анастомоза
(уровень доказательности С).
Панкреатические
свищи подлежат консервативной терапии и динамическому наблюдению с обеспечением
адекватного оттока панкреатического секрета. При наличии панкреатического свища
имеется реальная угроза возникновения аррозионного кровотечения (уровень
доказательности А).
Внутрибрюшное и кишечное кровотечения. Вероятность возникновения кровотечения после резекционных операций на ПЖ достигает 10%, при этом летальность составляет 1,2% [38, 45] (уровень доказательности А).
Кровотечения
после резекционных операции на ПЖ следует классифицировать согласно
рекомендациям международной группы исследователей в области хирургии ПЖ (ISGPS)
[51], при этом учитываются следующие факторы:
1 - время начала
кровотечения - 24 часа после завершения операции, разграничивают ранние и
поздние кровотечения;
2 - тяжесть
кровотечения - показатель гемоглобина и необходимость переливания компонентов
крови;
3 - источник и
локализация кровотечения – внутрипросветное (в просвет желудочно-кишечного
тракта), либо внутрибрюшное кровотечение [54] (уровень доказательности А).
Время начала кровотечения (ISGPS.,
раннее –
возникает в первые 24 часа после операции, вызвано техническими причинами:
неадекватный гемостаз во время операции, коагулопатия, повреждение стенки
сосуда коагуляцией при выполнении лимфадиссекции;
позднее –
возникает более чем через 24 часа от момента окончания операции; причинами кровотечения
являются послеоперационный панкреатит и панкреатический свищ, внутрибрюшные
абсцессы, изъязвления на месте анастомоза, формирование артериальной
псевдоаневризмы (уровень доказательности А) [6].
В многоцентровом
исследовании, проведённом E. Yekebas (2007) на основе анализа 1669 резекционных
вмешательств на ПЖ, модифицирована классификация кровотечений по степени
тяжести ISGPS (уровень доказательности А) [53].
1. «Сторожевое
кровотечение», характеризуется непродолжительным поступлением небольшого
количества крови по дренажам из брюшной полости или назогастральному зонду,
может быть рвота «кофейной гущей» или мелена; отсутствуют клинические
проявления острой кровопотери (тахикардия, снижение артериального давления),
уровень гемоглобина не понижается более 15 г/л. Кровотечение прекращается
самостоятельно, необходимости в гемотрансфузии нет. При этом рецидив
кровотечения возможен в течение 12 часов.
2. Неинтенсивное
пострезекционное кровотечение характеризуется поступлением крови по дренажам из
брюшной полости, снижением уровня гемоглобина до 30 г/л, наличием клинических
проявлений острой кровопотери либо без
них.
3. Интенсивное
пострезекционное кровотечение характеризуется снижением уровня гемоглобина
более 30 г/л, наличием выраженных клинических проявлений острой кровопотери
[53].
Раннее послеоперационное кровотечение. Специфической особенностью операций при ХП (продольная
панкреатоеюностомия, операция Фрея, бернский вариант резекции головки ПЖ)
является образование большой раневой поверхности паренхимы ПЖ и значительная
протяженность рассечения стенки тощей кишки, используемой для
анастомозирования. В результате в ближайшем послеоперационном периоде может
возникать кровотечение в просвет анастомоза как из паренхимы ПЖ, так и стенки
тощей кишки. Клинические проявления сводятся к общим симптомам острой
кровопотери и мелене.
Раннее не
интенсивное кровотечение в просвет панкреатоеюноанастомоза подлежит консервативному
лечению. При интенсивном кровотечении следует выполнить экстренное
ангиографическое исследование, с последующей эмболизацией кровоточащего сосуда.
При отсутствии возможности выполнить эндоваскулярное вмешательство выполняют
экстренное хирургическое лечение. При релапаротомии необходимо разобщить
переднюю губу панкреатоеюноанастомоза и прошить кровоточащий сосуд, после чего
произвести реанастомозирование. Недопустимо делать энтеротомию через переднюю
губу анастомоза, так как это неизбежно приводит к несостоятельности швов из-за
нарушения кровоснабжения кишечной стенки.
Позднее послеоперационное кровотечение. Позднее кровотечение, являющиеся аррозионным, создает реальную угрозу для
жизни больного и требует при неинтенсивном кровотечении консервативной терапии,
а при интенсивном кровотечении – экстренного эндоваскулярного вмешательства с эмбилизацией
аррозированного сосуда или экстренной релапаротомии [4, 5]. При релапаротомии
необходимо учитывать состояние панкреатодигестивного анастомоза, культи ПЖ и
парапанкреатической клетчатки. Кровотечение на момент операции может
прекратиться, что существенно затрудняет выявление его источника. Послеоперационный
панкреонекроз и некротический парапанкреатит, в сочетании с аррозионным
кровотечением из магистральных сосудов, является неблагоприятным фактором и,
как эксклюзивная мера, может потребовать выполнения экстирпации поджелудочной
железы и спленэктомии.
Рекомендации
Поcлеоперационные неинтенсивные кровотечения
требуют консервативной терапии. Для уточнения источника кровотечения следует
выполнить ангиографию (уровень доказательности А).
При обнаружении
во время ангиографического исследования кровоточащей артерии показано
выполнение ее эмболизации (уровень доказательности В).
При интенсивном
кровотечении и отсутствии возможности выполнения эндоваскулярного вмешательства
требуется экстренное хирургическое лечение. При кровотечении из мягких тканей и
при отсутствии панкреонекроза, некротического парапанкреатита возможно
обеспечить гемостаз за счет прошивания. При аррозионном кровотечении из
магистральных сосудов (мезентерикопортальный ствол, селезеночная вена, артерии
бассейна чревного ствола и верхняя брыжеечная артерия), возникшем в результате послеоперационного
панкреонекроза, возможно выполнение панкреатэктомии и спленэктомии (уровень доказательности
D).
Заключение
ХП является часто встречающимся заболеванием, поражающим работоспособное население. При несвоевременном радикальном лечении болезнь приводит к стойкой инвалидности, ухудшает качество и уменьшает продолжительность жизни. При кажущейся простоте диагностики ХП не редко возникают трудности в проведении дифференциального диагноза с опухолевым поражением ПЖ и прилежащих органов. Для определения тактики лечения этих больных, выбора оптимального варианта предстоящей операции, необходимо комплексное лучевое обследование. Последнее должно выполняться на современной аппаратуре, а интерпретация полученных данных осуществляться профессионалами высокого класса. Операции, направленные на устранение осложнений ХП, относятся к числу наиболее сложным в абдоминальной хирургии и сопровождаются значительным количеством осложнений. Эффективное радикальное лечение больных ХП может быть обеспечено лишь в специализированных клиниках, обладающих большим опытом лечения этого заболевания.
Список литературы
1.Воробей А.В., Шулейко А.Ч., Гришин И.Н. и соавт. Патогенетическое обоснование первичных и повторных операций на поджелудочной железе при хроническом панкреатите. Анналы хирургической гепатологии. 2012; 3(17): 80-88.
2. Климович В.В. Октреотид в хирургической гастроэнтерологии. Рецепт. 2003; 4: 44-48.
3. Кригер А.Г., Кубышкин В.А., Кармазановский Г.Г. с соавт. Послеоперационный панкреатит при хирургических вмешательствах на поджелудочной железе. Хирургия. Журнал им. Н.И. Пирогова. 2012; 4: 14-19.
4.Кубышкин В.А., Кригер А.Г., Вишневский В.А. с соавт. Экстирпация дистальной культи поджелудочной железы при профузном внутрибрюшном аррозионном кровотечении, обусловленным послеоперационным панкреонекрозом. Хирургия. Журнал им. Н.И. Пирогова. 2012; 11: 4-7.
5. Кубышкин В.А., Козлов И.А., Кригер А.Г., Чжао А.В. Хирургическое лечение хронического панкреатита и его осложнений. Анналы хирургической гепатологии. 2012; 4: 24-35.
6.Кубышкин В.А., Кригер А.Г., Цыганков В.Н., Варава А.Б.. Лечение больных хроническим панкреатитом, осложненным ложными аневризмами артерий бассейна чревного ствола и верхней брыжеечной артерии. Вестник экспериментальной и клинической хирургии. 2012; V(1): 12-21.
7.Третьяк С. И., Ращинский С. М., Ращинская Н. Т. Варианты повторных и реконструктивных операций у больных хроническим панкреатитом. Анналы хирургической гепатологии. 2012; 2(17): 65-71.
8.Федоров В.Д., Кригер А.Г., Цыганков В.Н. Лечение больных с хроническим панкреатитом, осложненным ложными аневризмами артерий бассейна чревного ствола. Вестник хирургии им. И.И. Грекова. 2010; 169(1): 44-52.
9. Данилов М.В., Федоров В.Д. Хирургия поджелудочной железы: Руководство для врачей. - М.: Медицина, 1995; 512 с.
10.Щастный А.Т. Зависимость болевого синдрома и качества жизни больных хроническим панкреатитом от патоморфологических изменений поджелудочной железы. Анналы хирургической гепатологии. 2011; 4(16): 83-90.
11.Adam U., Makowiec F., Riediger H. et al. Pancreatic head resection for chronic pancreatitis in patients with extrahepatic generalized portal hypertension. Surgery. 2004 Apr; 135(4): 411-418.
12.Ake A. Chronic pancreatitis. N Am J Med Sci. 2011 Aug; 3(8): 355–357.
13.Ammann R.W., Mullhaupt B. Do the diagnostic criteria differ between alcoholic and nonalcoholic chronic pancreatitis? J Gastroenterol. 2007; 42(Suppl 17): 118-126.
14.Arvanitakis M., Delhaye M., Bali M.A. et al. Pancreatic-fluid collections: a randomized controlled trial regarding stent removal after endoscopic transmural drainage. Gastrointest Endosc 2007; 65: 609-619.
15. Aspelund G., Topazian M., Lee J.H. et al. Improved outcome for benign disease with limited pancreatic head resection. J Gastrointest Surg. 2005; 9: 400–409.
16.Bassi C., Dervenis C., Butturini G. Postoperative pancreatic fistula: An international study group (ISGPF) definition. J Surgery. 2005; 138(1): 8-13.
17. Beger H.G., Büchler M., Bittner R. et al. Duodenum-preserving resection of the head of the pancreas in severe chronic pancreatitis: early and late results. Ann Surg. 1999; 209: 273–278.
18. Buchler M.W., Martignoni M.E., Friess H., Malfertheiner P. A proposal for a new clinical classification of chronic pancreatitis. BMC Gastroenterol. 2009; 9(1): 93-100.
19. Catalano M.F., Sahai A., Lavy et al. EUS-based сriteria for the diagnosis of chronic pancreatitis. Am J Gasrtoenterol. 2004; 99: 1350-1354.20. Catalano M.F., Sahai A., Levy M. et al. EUS-based criteria for the diagnosis of chronic pancreatitis: the Rosemont classification. Gastrointest Endosc 2009; 69: 1251-1261
21. Darge K., Anupindi S. Pancreatitis and the role of US, MRCP and ERCP. Pediatr Radiol. 2009; 39(Suppl 2): 153-157.
22. De Castro S.M., Busch O.R., Gouma D.J. Management of bleeding and leakage after pancreatic surgery. Best Pract Res Clin Gastroenterol. 2004; 18: 847-864.
23. DeRosa A., Gomez D., Pollock J.G. et al. The radiological management of pseudoaneurysms complicating pancreatitis. JOP. 2012 Nov; 13(6): 660-666.
24. Dumonceau J.M., Delhaye M., Tringali A. et al. Endoscopic treatment of chronic pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy. 2012; 44: 784–796.
25. Fankhauser G., Stone W., Naidu S. The minimally invasive management of visceral artery aneurysms and pseudoaneurysms. J Vasc Surg. 2011; 53: 966-970.
26. Frey C.F., Amikura K. Local resection of the head of the pancreas combined with longitudinal pancreaticojejunostomy in the management of patients with chronic pancreatitis. Ann Surg. 1994; 220: 492–507.
27. Friess H., Kleeff J., Buchler M.W. Molecular pathophysiology of chronic pancreatitis--an update. J Gastrointest Surg. 2003; 7(8): 943-945.
28. Frulloni L., Falconi M., Gabbrielli A. et al. Italian consensus guidelines for chronic pancreatitis. Dig Liver Dis. 2010; 42(Suppl 6): 381-406.
29. Galloro G., Napolitano V., Magno L. et al. Diagnosis and therapeutic management of cystic dystrophy of the duodenal wall in heterotopic pancreas. A case report and revision of the literature. JOP. 2008 Nov 3; 9(6): 725-732.
30. Glasbrenner B., Kahl S., Malfertheiner P. Modern diagnostics of chronic pancreatitis. Eur J Gastroenterol Hepatol. 2002; 14: 935-941.
31.Gloor B., Friess H., Uhl W., Buchler M.W. A Modified Technique of the Beger and Frey Procedure in Patients with Chronic Pancreatitis. Dig Surg. 2001; 18: 21–25.
32. Goh K. L. Chronic pancreatitis: aetiology, epidemiology and clinical presentation. Med J Malaysia. 2005; 60(Suppl B): 94-98.
33.Gueroult S., Parc Y., Duron F. et al. Completion pancreatectomy for postoperative peritonitis after pancreaticoduodenectomy: early and late outcome. Archives of Surgery. 2004; 139(1): 16–19.
34.Hoffmeister A., Mayerle J., Beglinger C. et al. Consensus guidelines on definition, etiology, diagnosis and medical, endoscopic and surgical management of chronic pancreatitis German Society of Digestive and Metabolic Diseases (DGVS). Z Gastroenterol. 2012; 50(11): 1176-1224.
35.Itaru N., Tomoaki A., Masashi S. Hemosuccus Pancreaticus Associated with Segmental Arterial Mediolysis Successfully Treated by Transarterial Embolization. J Pancreas (Online). 2010 Nov 9; 11(6): 625-629.
36.Jacobson B.C., Baron T.H., Adler D.G. ASGE guideline: The role of endoscopy in the diagnosis and the management of cystic lesions and inflammatory fluid collections of the pancreas. Gastrointest Endosc 2005; 61: 363-370.
37. Kalady M.F., Broome A.H., Meyers W.C. et al. Immediate and long-term outcomes after lateral pancreaticojejunostomy for chronic pancreatitis. Am Surg. 2001; 67: 478–483.
38.Koukoutsis I., Bellagamba R., Morris-Stiff G. et al. Haemorrhage following Pancreaticoduodenectomy: Risk Factors and the Importance of Sentinel Bleed. Dig Surg. 2006; 23: 224–228.
39. Lerch M.M., Stier A., Wahnschaffe U., Mayerle J. Pancreatic pseudocysts: observation, endoscopic drainage, or resection? Dtsch ArzteblInt. 2009; 106(38): 614–621.
40. Morgan K.A., Adams D.B. Management of internal and external pancreatic fistulas. Surg Clin North Am. 2007; 87(6): 1503-1513.
41. Morton J.M., Brown A., Galanko J.A. et al. A national comparison of surgical versus percutaneous drainage of pancreatic pseudocysts: 1997–2001. J Gastrointest Surg. 2005; 9: 15–20.
42.Мыльников А.Г., Шаповальянц C.Г., Паньков А.Г. с соавт. Энтеральное зондовое питание и селективная деконтаминация желудочно-кишечного тракта в лечении острого деструктивного панкреатита. Хирургия. Журнал им. Н.И. Пирогова. 2012; 2: 37-41.
43.Нестеренко Ю.А.., Шаповальянц С.Г., Зубков О.Б. Морфологические аспекты в хирургии хронического панкреатита. Хирургия. Журнал им. Н.И. Пирогова. 1993; 10: 19-24.
44.Perwaiz A., Singh А., Chaudhary A. Surgery for Chronic Pancreatitis. Indian J Surg. 2012 Jan–Feb; 74(1): 47–54.
45.Seong H.C., Hyoun J.M., Jin S.H. et al. Delayed hemorrhage after pancreaticoduodenectomy. Journal of the American College of Surgeons. 2004 Aug; 199(2): 186–191.
46.Sierzega M., Kulig P., Kolodziejczyk P. et al. Natural History of Intra-abdominal Fluid Collections Following Pancreatic Surgery. J Gastrointest Surg. 2013 Aug; 17(8): 1406–1413.
47.Spanier B.W., Dijkgraaf M.G., Bruno M.J. Epidemiology, aetiology and outcome of acute and chronic pancreatitis: An update. Best Pract Res Clin Gastroenterol. 2008; 22(1): 45-63.
48.Tamura R., Ishibashi T., Takahashi S. Chronic pancreatitis: MRCP versus ERCP for quantitative caliber measurement and qualitative valuation. Radiology. 2006; 238: 920-928.
49.Varadarajulu S., Trevino J., Wilcox C.M. et al. Randomized trial comparing EUS and surgery for pancreatic pseudocyst drainage. Gastrointest Endosc. 2010; 71: AB116-AB116.
50.Weber A, Schneider J, Neu B et al. Endoscopic stent therapy for patients with chronic pancreatitis: results from a prospective follow-up study. Pancreas. 2007; 34: 287-294.
51.Wente M.N., Johannes A. Postpancreatectomy hemorrhage (PPH) – An International Study Group of Pancreatic Surgery (ISGPS) definition. J Surgery. 2007; 142(1): 20-25.
52.Witzigman H., Max D., Uhlmann D. et al. Outcome after duodenum-preserving pancreatic head resection is improved compared with classic Whipple procedure in the treatment of chronic pancreatitis. Surgery. 2003; 134: 53–62.
53.Yekebas E., Wolfram L., Cataldegirmen G. et al. Postpancreatectomy Hemorrhage: Diagnosis and Treatment. An Analysis in 1669 Consecutive Pancreatic Resections. Annals of Surgery. 2007; 246(2) 269-280.
54. Zealley I.A., Tait I.S., Polignano F.M. Delayed massive hemorrhage after pancreatic and biliary surgery: embolization or surgery? Ann Surg. 2006; 243: 138-139.
55.Sarles H., Adler G., Dani R. et al. The pancreatitis classification of Marseille-Rome 1988. Scand J Gastroenterol. 1989; 24: 641-642.
56. Sarles H. Classification and definition of pancreatitis. Marseilles-Rome 1988. Gastroentérologie Clinique et Biologique. 1989; 13(11): 857-859.
57.Степанова Ю.А., Кармазановский Г.Г., Кубышкин В.А. с соавт. Лучевые методы диагностики кистозной формы дуоденальной дистрофии. Анналы хирургической гепатологии. 2009; 2: 94-
58.Кармазановский Г.Г., Козлов И.А., Яшина Н.И. с соавт. Компьютерно-томографические критерии выбора метода и оценки результатов хирургического лечения хронического панкреатита. Медицинская визуализация. 2006; 3: 75-87.
59.Frullonia L., Gabbriellib A., Pezzillic R. et al. Chronic pancreatitis: Report from a multicenter Italian survey (PanCroInfAISP) on 893 patients. 2009 April; 41(4): 311–317.
60. Charles F. Frey, M.D., Kathrin L. Mayer, M.D. Comparison of Local Resection of the Head of the Pancreas Combined with Longitudinal Pancreaticojejunostomy (Frey Procedure) and duodenum-Preserving Resection of the Pancreatic Head (Beger Procedure). World J Surg 2003;27:1217-1230